Quote:
Originariamente inviata da carla
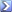
9-1) Una soluzionecontenente 8,75 ppm di KMnO4 ha una trasmittanza di 0,743 in una celletta di
1,00 cm a 520 nm. Calcolare l’assorbanza specifica molare di KMnO4. [ 2,33×103 l mol-1cm-1]
 |
-LogT = -Log(0.743) = 0.129 = A = C*e*B
dove (secondo la legge di Lambert Beer)
C = conc. molare
b = cammino ottico = lunghezza della cuvetta/celletta = 1cm
e = assorbanza specifica molare o coefficiente di estinzione molare
=>
ci sono 8.75 g di KMnO4 in 10^6 mL di soluzione
Mr(KMnO4) = 158g/mol
=> ci sono 8.75g/158g/mol = 0.0554mol di KMnO4 in 10^3L di soluzione
=> 0.0554mol / 10^3L = 5.54*10^-5M = C
=> e = A/ (b*C) = 0.129 / (5.54*10^-5*1) = 2329.4M^-1*cm^-1
__________________
Lezioni e svolgimento di esercizi di CHIMICA on line!
http://chimicaonline.xoom.it
Sono anche su facebook, ID: Lachimica On Line
