Quote:
Originariamente inviata da string
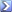
Quanti g di ftalato acido di potassi (MM = 204,233) si dovranno pesare in un matraccio per standardizzare NaOH ~0,05 M se si vogliono utilizzare ~ 30 ml di base per la titolazione? [0,30g]
|
Lo ftalato acido di potassio è uno standard primario ideale: è un soluto cristallino, con elevato peso molecolare. L'acido ftalico è una molecola simile al benzene, contenente due gruppi COOH in posizione 1 e 2; lo ftalato, è LA STESSA molecola, ma sostituita ad un H.
La formula chimica dello ftalato acido di potassio, è
KH -Ft (dove
Ft indica appunto lo ftalato).
Si tratta, in questo esercizio, di una reazione di neutralizzazione (si hanno infatti l'acido e una base -NaOH).
Durante la neutralizzazione, le moli di base usate per la reazione, DEVONO ESSERE UGUALI alle moli di acido.
Quindi, si comincia col calcolare le moli della base (esprimendo il Volume il litri):
n=M X V = 0,005 X 0'003 = 0,0015
Questo valore, corrisponde anche alle moli di ftalato, come detto precedentemente!!
Dunque, note le moli di ftalato, se ne possono determinare i grammi:
g= n X MM = 0,0015 X 204,233 = 0,30 g
In bocca al lupo!!
Violetta



 Discussioni simili
Discussioni simili