Quote:
Originariamente inviata da string
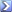
10 ml di una soluzione di solfato ammonico vengono trattati con un eccesso di NaOH.
L'ammoniaca gassosa che si sviluppa reagisce con 50 ml di HCl 0,1 N. Per titolarel'acido rimasto sono necessari 21,5 ml di NaOH 0,098 N. Calcolare la molarità della soluzione di
(NH4)2SO4 [ R = 0,145 M]
|
1)Si calcolano le moli di NaOH (il volume deve essere espresso in litri):
n=MxV= 0,098 x 0,215 = 0,02107
Da ricordare che la normalità può essere messa in relazione con la molarità secondo l'espressione: N=M X
n
per ile basi
n= numero di OH, e nel nostro caso
n=1 quindi molarità e normalità coincidono.
2)Queste sono anche le moli di HCl, perchè la traccia diche che l'acido è stato titolato con tale quantità di NaOH.
3)Pertanto, nella formula:
Ma x Va = Mb x Vb
(dove: M=molarità, e V=volume)
l'unica incognita resta la Molarità de di NH3 che ha reagito con HCl!
Infattila molarità dell'acido è 0,1M (anche in questo caso M=N); il volume dell'acido si calcola facendo n/M (nel nostro caso: 0,02107/ 0,1), e il volume della base è dato dalla traccia.
Si determinerà dunque, con pochi calcoli, la molarità della soluzione contenente la base.
Sono stata un po' sintetica, ma penso che questi passaggi non richiedano molte spiegazioni.
In ogni caso, fammi sapere e cercherò di essere più chiara!
Violetta



 Discussioni simili
Discussioni simili