Quote:
Originariamente inviata da string
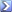
Calcolare il pH a ciascuno dei punti indicati , per la titolazione di 50,0 ml di acido formico (Ka= 1,80×10-4) 0,050 N con KOH 0,050 N. I punti da calcolare sono: Vb = 0,0; 10,0; 20,0; 25,0; 30,0; 40,0; 45,0;48,0; 49,0; 49,5; 50,0; 51,0; 52,0; 55,0 e 60,0 ml. Riportare in grafico il pH in funzione di Vb e scegliere l’indicatore opportuno. [R = 2,54; 3,14; 3,57; 3,74; 3,92; 4,35; 4,70; 5,13; 5,44; 5,74; 8,07;10,69;10,99; 11,38; 11,66; fenoftaleina] |
Questo esercizio richiede la curva di titolazione (=il grafico che rappresenta la variazione del pH della soluzione di acido formico all'aggiunta di ioni OH-). Sull'asse delle ordinate verrà indicato il pH, mentre sull'asse delle ascisse si indicherà il valore di KOH aggiunto man mano.
Per la curva di titolazione, dovendo fare il grafico al PC, puoi usare excel. In una colonna scrivi i millilitri aggiunti ,nell'altra i valori corrispondenti di pH.Scegli come tipologia di grafico : dispersione ( XY ).
Intorno al punto di equivalenza ( p.e. ) si verifica una notevole variazione del pH in quanto, vicino alla neutralità anche un piccolo eccesso di base o di acido provoca notevoli variazioni della concentrazione degli stessi ioni e, di conseguenza, del pH.
Laddove vengono effettuate letture vicine tra loro (dalla traccia: 48- 49- 49,5- 50- 51- 52....) si deve cogliere precisamente il punto di equivalenza (pH = 7). Dopo si continua l'operazione.
I valori di pH salgono progressivamente all’aggiunta di KOH
Il pH iniziale della soluzione è calcolato:
Nfin.=Viniz.*Niniz./Vfin.
Ottenuta la concentraszione di H+, si ricorda che:
pH=-log[H+]
Per quanto riguarda la scelta di un opportuno indicatore, è da ricordare che per ogni indicatore il cambio di colore avviene entro un intervallo di pH caratteristico dell'indicatore considerato.
Nel caso delle titolazioni acido-base l'indicatore deve essere scelto in modo tale che il suo intervallo di viraggio cada in corrispondenza del salto di pH. In questo modo il cambiamento di colore dell'indicatore evidenzia il raggiungimento del punto equivalente.
Nel nostro caso, il salto di pH si avrà più o meno (non ho la possibilità di fare calcoli precisi) intorno a pH 8,5-9; com'è noto, l'intervallo di "viraggio" - il cambio del colore- è compreso tra pH 8,0-9,8 se l'indicatore usato è la fenoftaleina: questo indicatore rende la soluzione che la contiene incolore se è acida, e rosso-violetta se è basica.