Quote:
Originariamente inviata da string
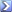
Un campione di 0,3367 g di Na2CO3 (MM = 105,989) di grado standard primario ha richiesto 28,66 ml di una soluzione di H2SO4 per la titolazione. Qual è la molarità dell’acido solforico? [R= 0,11M]
|
Una titolazione acido-base ha lo scopo di determinare la concentrazione di una soluzione di un acido PER ES., misurando la quantità in volume di una base a titolo noto che reagisce in modo completo con un volume noto della soluzione da titolare.
Nel nostro caso abbiamo 0,3367 g di Carbonato di sodio (il cui peso molecolare indicato con MM nella traccia, è noto), titolato con un volume noto di acido solforico.
Si può applicare la formula (che è una uguaglianza, NON una proporzione!!):
V1 · M1 = V2 · M2
(dove con -1- indicheremo i dati relativi al carbonato, e con -2- i dati relativi all'acido).
NON abbiamo nè volume nè molrità del carbonato, ma è noto che
M X V =n
e che le moli si calcolano applicando la seguente formula:
n = g/MM
quindi:
n = 0,3362/ 105,989 = 0,0032
La nostra formula allora diventa:
n1 = V2 X M2
e l'unica incognita è M2!
Si calcola dunque M2 con la formula inversa (ricordando di esprimere il volume in litri!):
M2 = n1 / V2
M2 = 0.0032 / 0,02860 = 0,11
In bocca al lupo!
Violetta