Quote:
Originariamente inviata da zicchinet
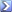
50 mL di Fe 2+ 0.0200 M sono titolati con Ce 4+ 0.0400 M . Calcolare il potenziale al punto di equivalenza sapendo che E 0 Ce 4+ /Ce 3+ = 1.44 V; E 0 Fe 3+ /Fe 2+ = 0.68V.
|
In questa redox, abbiamo che il cesio acquista 1 elettrone (si riduce) e il ferro perde un elettrone (si ossida). Nella semicella contenente Ferro, cioè, viene perso l'elettrone che, attraverso il ponte salino, verrà acquistato dal cesio presente nell'altra semicella.
Le due semireazioni quindi saranno bilanciate dal punto di vista degli elettroni:
Fe+++ --> Fe++
Ce++++ --> Ce+++
Si calcolano le moli di ferro:
n= M x V = 0,200 x 0,05 (l) =...
Il potenziale standard di riduzione, il cui simbolo è E° (e nel nostro caso vale 1,44),permette di prevedere la spontaneità di una redox.
L'equazione di Nernst, per calcolare il potenziale al punto di equivalenza, è la seguente:
E = E° - (RT/nF)*logQ
--dove Q è la costante non all' equilibrio
logQ=ln [OX]/[RID]
--dove n sono le moli di Fe
--dove RT/F è un rapporto che ha sempre lo stesso valore (0.082057 L atm mol-1 K-1), ricavabile dai dati qui riportati:
T a 25°C = 298.15K
R = 0.082
F = 96500 C/mol