Quote:
Originariamente inviata da DNAnna
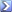
MM H2SO4= 98,08 u.m.a.
Poiché l’acido solforico è un acido fortissimo, all’equilibrio risulterà praticamente tutto
dissociato secondo lo schema seguente.
Bisogna fare attenzione che si tratta di un acido diprotico, cioè che fornisce due ioni H+
per ogni molecola che si dissocia in soluzione acquosa.
__________H2SO4 <->__ 2H+__ +__ SO42-
Inizio_____5*10^-3M____0__________0
Equilibrio____0_______2*5*10^-3____5*10^-3
All’equilibrio si ha [H+] = 2*5*10^-3 = 10^-2M
Quindi
pH = -log[H+]
pH = - log10^-2
pH=2
|
SBAGLIATO!!!
L'acido solforico è un acido forte solo ed esclusivamente in prima dissociazione. Nella seconda dissociazione è considerato un acido debole.
H2SO4 -> HSO4- + H+
Lo ione HSO4- è in equilibrio con lo ione solfato e lo ione H+ (Ka= 10^-2)
Ma questa ultima dissociazione è trascurabile rispetto alla prima...
Ai fini del calcolo del pH di una soluzione acquosa di questo acido, non puoi considerarlo come diprotico...ma come monoprotico.