Quote:
Originariamente inviata da ale90
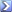
100 mg di acido acetico (CH3COOH) sono sciolti in 150 ml di acqua. Calcolare il pH (Ka = 1.8 *10^-5).
Ragazzi scusate se posto tanti esercizi... ma mi serve una mano.... Help!
Grazie in anticipo!
|
Per prima cosa ci troviamo le moli di acido acetico.
Calcoliamo la molarità della soluzione di acido acetico facendo le moli diviso il volume d'acqua.
Essendo l'acido acetico un acido debole, la concentrazione degli ioni H+ non sarà uguale alla Ca (come per gli acidi forti).
[H+]=radice quadrata(Ca*Ka).
Controlliamo che il dato sia corretto, verificando che i rapporto [H+]/Ca < 0,05.
quindi puoi calcolarti il pH.