Quote:
Originariamente inviata da pulcino
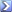
Trovare il pH di un litro di soluzione che contiene 0,1 moli di CH3COOH e 5 grammi di CH3COONa. Ka = 1,8·10-5. Come varia il pH aggiungendo 2 g di H2SO4?
|
1)Questa è chiaramente una soluzione tampone.
Abbiamo un sale (acetato di sodio ) CH3COONa. Il peso-formula dell’acetato di sodio è 82.
Per calcolarne le moli, e' sufficiente una proporzione: 5 grammi di questo sale corrispondono a:
82 : 1 = 5 :
X
da cui
X = 0,061 moli
2) Si tratta di una soluzione formata da un acido debole e dalla sua base coniugata mescolate in quantità quasi uguali: essa è quindi una soluzione tampone, come detto prima. La base coniugata CH3COO- è in pratica nella stessa concentrazione del sale.
3)Per calcolare il pH, si calcola la formula prevista per le soluzioni tampone (da ricordare che il pK è il log della Ka):
pH = pK + log [(conc sale)/(conc. acido)]
pH = 4,74 + log (0,061/0,1) = 4,53
Questa è la risposta alla prima domanda
4)Consideriamo ora H2SO4 un acido forte completamente dissociato:
H2SO4 --> 2 H+ + SO4- -
Due grammi di acido solforico corrispondono a
n= g : PM
n= 2 : 98 = 0,02 moli.
Le moli di H+ saranno il doppio di questa quantità, cioè 0,04.
5)Consideriamo ora l’equilibrio:
CH3COOH + H2O --> CH3COO- + H3O+
Esso,
per aggiunta di 0,04 moli di H+ provenienti dall’acido solforico, si sposterà a sinistra, facendo aumentare le molecole di acido acetico e di conseguenza diminuire gli ioni acetato (in pratica facendo diminuire la quantità di sale).
Avremo pertanto:
pH = pK + log [(0,061 - 0,04 )/(0,1+0,04)]
pH = 4,74 + log 0,021/0,14 = 3,92
Questo è il nuovo pH, cioè la risposta alla seconda domanda
COMUNQUE TI CONSIGLIO DI RIFARE I CALCOLI, PERCHE' SONO ANDATA UN PO' IN FRETTA.
IN BOCCA AL LUPO!!!
Violetta