Quote:
Originariamente inviata da string
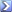
Calcolare il pH di una soluzione 0,1 M di acido acetico (CH3COOH), sapendo che la sua Ka è 1,8•10-5. (risoluzione: pH = 2,88)
|
1)L'acido acetico si dissociasecondo il seguente equilibrio:
CH3COOH
--> CH2COO-
+ H+
2)In fase inziale, le concentrazioni dell'acido e degli ioni saranno rispettivamente di 0,1 -0 -0 (non ci sono ioni inizialmente!); al termine dell'equilibrio, le concentrazioni varieranno, perchè l'acido si è dissociato di una quota X che non è nota, allora le concentrazioni sarnno rispettivamente: (0,1-x) -x- x.
CH3COOH = (0,1-x)M
H+ = (x)M
CH3COO- = (x)M
Ka =
X x
X/(0.1-x) = 1,8*10-5
Considerando trascurabile la X al denominatore, l'unica incognita resta il prodotto
X x
X al numeratore.
Quindi si calcola la X risolvendo una radice quadrata.
X= radice quadrata di
(Ka)x0,1
3)Poichè il pH è un logaritmo negativo:
pH= -log X
In bocca al lupo, ciao!



 Discussioni simili
Discussioni simili