Quote:
Originariamente inviata da string
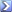
Calcolare il pH di una soluzione 10-2 M di ammoniaca (NH3), sapendo che la Kb di questa base è 1,8•10-5 (risoluzione: pH = 10,62)
|
1)Forse il problema nasce dal fatto che apparentemente l'ammoniaca (NH3) non possiede alcun gruppo ossidrilico. Eppure ha comportamento basico.
In realtà occorre considerare la sua reazione di dissociazione in acqua (come del resto accade per tutte le basi!!):
per definizione, NH3 essendo una base accetta H+ dell'acqua, e in soluzione resteranno gli OH-
NH3 + H2O → NH4+ + OH-
2)Ora non resta che applicare la normale formula di dissociazione in cui le concentrazioni di NH4+ e OH- corrispondono all'incognita X.
Per calcolare tale X, si utilizza la formula seguente, considerando trascurabile la quantità di X al denominatore:
Kb= [NH4+]
x [OH-] / [NH3]
Kb = X
x X / 10-2
3)Da questa formula (facendo la radice quadrata) si ricava il valore di X.
4)Però ricorda che X è semplicemente la [OH-]!!
Di tale valore, dovrai calcolare il pOH (facendone il log)
5)Per calcolare il pH, basta ricordare che
pH + pOH = 14
Per differenza, dunque, troverai il pH.
IN BOCCA AL LUPO!!
Violetta



 Discussioni simili
Discussioni simili