Quote:
Originariamente inviata da string
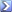
Calcolare la massa di NaOH (MM 40) da aggiungere a 1,2 L di una soluzione 0,15 M di acido fosforico per preparare un tampone a pH 11,8. La costante di dissociazione dell’acido fosforico : Ka1 = 7,11×10-3 [R= 16,6g]
|
Una soluzione tampone è una soluzione acquosa in grado di mantenere inalterato il proprio pH, in seguito all'aggiunta di moderate quantità di acidi o basi forti.
Hanno potere tampone le soluzioni contenenti un acido debole e il suo sale con una base forte (e questo è il nostro caso); oppure una base debole e il suo sale con un acido forte.
Come è noto, il calcolo del pH per una soluzione tampone, è dato dalla seguente formula (ricavata con passaggi matematici, pertendo dall'assunto che si possono approssimare la concentrazione all'equilibrio dell'acido genericamente detto HA con il suo valore nominale Ca
e la concentrazione all'equilibrio dell'anione dissociato con quella nominale del sale Cs):
pH = PKa + log Cs - log Ca
Questa è la formula di Henderson- Hasselbalch, che si può anche scrivere:
pH= pKa + log (sale)/(acido)
dove
pKa rappresenta il logaritmo dell'inverso della costante di dissociazione dell'acido e le concentrazioni del sale e dell'acido sono espresse in molarità.
Essendo il valore di K costante in un largo campo di diluizione, è possibile calcolare il pH di una soluzione dalla concentrazione dei componenti del tampone e, viceversa, dalla determinazione del pH si può risalire al rapporto dei componenti, ed è questo il nostro caso poichè il pH è noto (pH= 11,8).
Sostituendo i valori, avremo:
11,8= -log 7,11X10-3
+ Log Cs
+ Log 0,15
da cui si deve ricavare il valore del log Cs:
log Cs = 11,8
+ log 7,11X10-3
+ log 0,15
Svolgendo i calcoli, si ottiene il valore di Cs, cioè la concentrazione (espressa in molarità) del sale.
Si possono dunque determinarne le moli, infatti il Volume è noto (è di 1,2 litri!):
n = MxV
Ottenute le moli, si determinano i grammi, infatti il peso olecolare è noto (MM=40):
g = n X MM
---------------------------------------------------------
Ciò fatto, ripeti gli stessi calcoli modificando semplicemente il valore della costante di equilibrio, in ogni equazione di Henderson- Hasselbalch.
Otterrai alla fine tre valori diversi di grammi.
Fai la media aritmetica, e otterrai la massa in grammi che occorre esattamente per ottenere un tampone a pH 11,8.
In bocca al lupo!
Violetta