Quote:
Originariamente inviata da zicchinet
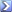
Un campione di 1.38 g contenente ossidi di ferro e zinco è stato disciolto in acido e diluito a 250,00 mL. Ad un'aliquota di 25,00 mL è stato aggiunto fluoruro di potassio per mascherare il ferro e dopo l'opportuna regolazione del pH sono stati necessari 35.2 mL di EDTA 0.0100 M per titolare lo Zn 2+ .
Calcolare la percentuale di ZnO presente nel campione.
|
-L'EDTA (acido etilendiamminotetraacetico) è un acido carbossilico con due doppietti elettronici liberi, dunque ha la possibilità di formare forti legami con alcuni cationi bivalenti (=atomi con carica
2+) come zinco, rame, calcio.
Nota la quantità (in moli) di EDTA, si possono calcolare anche le moli del catione che con esso ha reagito.
Inizialmente, per la soluzione dell'esercizio, si lavora nei primi 25 ml di soluzione (ovvero, al momento in cui sono state fatte le titolazioni).
Si calcolano le moli di EDTA:
n= M x V = 0,100 x 0,325
(da ricordare che il volume va espresso in litri).
-Poichè, come detto, l'EDTA reagisce con i cationi bivalenti, sicuramente reagità con Zn++, per cui le moli di EDTA sono anche le moli di Zn++:
n EDTA =
n Zn ++
-Ma a noi serve la quantità di Zn++ nel volume di 250 ml! Quindi, impostando una semplice proporzione, si calcolano le moli di Zn++ nel volume tutale:
n Zn++ : 0,025 =
n Zn++ : 0,25
(ho indicato l'incognita con la scritta in corsivo).
-Occorrono i grammi di ZnO; non è possibile lavorare con i pesi molecolari degli ioni, per cui si userà il peso molecolare di ZnO:
g (di ZnO) =
n Zn++ x PM
-Per avere lo stesso risultato, ma espresso in percentuale, si fa una proporzione:
g (di ZnO) : 1,38 = % : 100
Dott.ssa Raffaella Russo