Quote:
Originariamente inviata da zicchinet
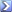
L'azione alcalina di iodio sul veleno per roditori Varfarina, C 19 H 16 O 4 (PM 308.34) consiste nella formazione di una mole di Iodoformio, CHI 3 , per ogni mole di Varfarina. L'analisi della Varfarina è quindi basata sulla reazione tra CHI 3 e Ag + : CHI 3 + 3 Ag + + H 2 O → 3 AgI (s) + 3 H + + CO
Il CHI 3 prodotto da un campione di 12,82 g è stato trattato con 25 mL di AgNO 3 0.0325 M e l'eccesso di Ag + è stato successivamente titolato con 3.45 mL di KSCN 0.06535 M .
Calcolare la percentuale di Varfarina nel campione.
|
non ho letto le risposte altrui fino in fondo per non lasciarmi influenzare, ma ho capito che ci sono più versioni: vi propongo la mia e stiamo a vedere...
meq(varfarina) = meq(CHI3) = meq(AgNO3) - meq(KSCN)
meq(AgNO3) = mmol(AgNO3)*1
(1 perchè si forma 1 mole di AgI da 1 mole di AgNO3 => ha valenza 1 nella reazione col cloroformio)
quindi
meq(AgNO3) = mmol(AgNO3) = 0.0325mol/L * 25mL = 0.8125mmol
meq(KSCN) = mmol(KSCN) poichè anche per la retrotitolazione il rapporto è 1:1,
Ag+ SCN- ----> AgSCN
quindi
meq(KSCN) = mmol(KSCN) = 3.45 mL*0.06535mol/L = 0.2255
quindi
meq(CHI3) = 0.8125 - 0.2255 = 0.587
mmol(CHI3) = meq(CH3I) / 3 = 0.196 = mmol(varfarina)
0.196mmol*PM(=308.34g/mol) = 60.33mg
60.33 / 12820 * 100 = 0.47%