Quote:
Originariamente inviata da zicchinet
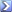
Un campione di 1.38 g contenente ossidi di ferro e zinco è stato disciolto in acido e diluito a 250,00 mL. Ad un'aliquota di 25,00 mL è stato aggiunto fluoruro di potassio per mascherare il ferro e dopo l'opportuna regolazione del pH sono stati necessari 35.2 mL di EDTA 0.0100 M per titolare lo Zn 2+ .
Calcolare la percentuale di ZnO presente nel campione.
|
Il risultato è: 20,77% di ZnO nel campione
Spiegazione: l'EDTA è in grado di coplessare cationi bivalenti formando dei complessi nel rapporto 1:1. Conoscendo perciò le moli di EDTA che hanno reagito con lo Zn 2+ (tali moli si ricavano dalla molarità dell'EDTA e dai mL utilizzati: 0.0100 mol: 1000 mL=x mol: 35.2mL), si ricavano le moli di Zn2+.
Le moli di Zn2+ trovate sono però nella frazione di 25 mL, impostando un'altra proporzione si possono trovare e moli nei 250 mL iniziali.
A questo punto,si ricavano i grammi di ZnO, moltiplicando le moli per il peso molecolare dello ZnO.
I grammi di ZnO/grammi di campione per 100 danno la percentuale cercata.